在这之前国内还没有一家大分子生物创新药完全依靠自己团队通过FDA审批在美上市。
近几年,虽然国产创新药License-out蔚然成风,但市场真正的主角属于依靠自己的研发体系将创新药成功推动在美上市的药企。
而今天,这一状况被一家中国本土黑马打破了!2023年11月17日,亿帆医药公告旗下亿一生物自主研发的第三代长效粒细胞集落刺激因子(G-CSF-Fc融合蛋白)“艾贝格司亭α注射液”(中国商品名“亿立舒”,
美国商品名“Ryzneuta”)正式获得美国FDA批准上市,用于预防肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症。
这是全球首个双分子G-CSF-Fc融合蛋白,也是首个由中国本土大型Pharma依靠自有团队完成海外多中心临床试验、FDAGMP检查并推动成功在美国上市的大分子创新药。
跨越近20年的创新接力

亿帆医药对于创新是有先见的。
把时间拨回到2016年,彼时,仿制药一致性评价、带量采购、医保谈判等医药政策尚未落地,对于本土药企固守传统的仿制药业务仍然是舒服和安逸的状态,创新药正处于朦胧状态,大部分企业都没有all in的魄力。而亿帆医药却充分感知到创新药是未来的风向标,毫不犹豫选择躬身入局转型做创新药。
2016年7月,亿帆募集10亿元收购下了亿一生物的前身健能隆的控制权。这放在医药投融资市场较为成熟的今天来看,都是一笔体量相当大的创新药企并购交易,也足见亿帆医药转型创新药的信心和决心。
资料显示,健能隆创立于2004年,是中国最早一批的创新药Biotech,也是国内第一家在美国进入II/III期临床的生物药研发企业,借助此次收购,亿帆医药开始接力健能隆的创新药事业,并进一步打开创新药出海的局面。
Ryzneuta?从立项到如今获得美国FDA批准上市耗时长达15年,经历了早期创新研发小团队到亿帆医药的接续努力,前后自主研发投入达到13亿元。值得一提的是,不同于中国Biotech创新药出海靠外部融资输血,公司创新药的研发弹药是靠自己内部输血。
掘金全球60亿美元市场

企业出海的核心在于创新药的市场空间,以Ryzneuta?代表的升白药为例,根据 IQVIA 数据统计显示,2022年G-CSF全球市场份额超过60 亿美元,国内空间为100亿元,两者相差4倍多。
近年来,国产创新药出海的业绩,验证海外商业化潜力。例如,2019年12月,百济神州泽布替尼成为我国首个在美上市创新药。该药中美销售额正逐步拉大,今年上半年全球销售额25亿元,远超国内7亿元销售额。原因在于中美药价巨大差距,最终反应于销售额差异。另外,2022年2月,传奇生物旗下的西达基奥仑赛获得在美上市申请,今年上半年销售额近2亿美元,作为后来者,凭借良好疗效,Q2市场份额已接近Abecma。
在亿帆医药丰富的出海、研发、注册及商业化实践经验支持下,Ryzneuta?在国内外的研发及商业化进展也更加迅速。
国内市场方面,2023年5月9日,国家药品监督管理局网站显示,亿立舒获批上市。而在此之前,亿一生物已经和中国生物制药旗下核心企业正大天晴药业集团签署商业化合作协议,共同推进亿立舒在国内的商业化。根据公开数据查询,截至2023年10月15日,亿立舒?在全国二十六个省/市完成招标挂网。
海外市场方面,Ryzneuta?在亿帆医药的执掌下一步步稳扎稳打,2017年11月,Ryzneuta?首个全球多中心三期临床试验达到首要和次要终点。2020年3月,Ryzneuta?第二个全球多中心三期临床试验达到首要终点。2021年5月,Ryzneuta?获得美国FDA上市申请并获受理,并于2023年11月17日最终获得美国FDA批准上市。
医药魔方注意到,早Ryzneuta?在美国获批上市前,其全球商业化的蓝图就已徐徐拉开帷幕。借助全球商务BD团队,Ryzneuta?在上市前已经寻找到不少具备专业推广和销售能力的区域性商业合作伙伴。
2022年2月28日,新加坡亿一宣布同意将Ryzneuta?在德国的独家经销权许可给APOGEPHA公司,并由此将获得APOGEPHA支付的不可退还的40万美元预付款、最高不超过100万美元开发里程碑付款及最高不超过3750万美元的销售里程碑付款。
2022年4月22日,爱尔兰亿一宣布将Ryzneuta?在瑞士的独家经销权许可给APOGEPHA公司,并由此将获得APOGEPHA支付的最高额不超过697.5万美元的首付款、法规、开发及销售里程碑付款。
2022年11月14日,美国亿一宣布同意将Ryzneuta?在美国的独家经销权许可给ACROTECH公司,并由此将获得ACROTECH公司支付的最高额不超过2.365亿美元的独家许可费(首付款、里程碑付款),以及两位数的分级净销售额提成费。公司将借助ACROTECH公司在创新肿瘤专利药物领域丰富的销售经验及遍布美国50个州广泛的销售队伍和完善的销售网
络,快速打开Ryzneuta?在美国的市场,提高Ryzneuta?在全球市场的影响力和市占率。
截至8月底,在产品境外最终获批上市前,公司已在美国、德国、瑞士、奥地利、希腊、塞浦路斯、巴西、新加坡、阿根廷等 30 余个国家或地区成功确定合作伙伴并签署商业化合作协议。
在商业化之外,亿帆医药已经建立了可满足全球不同国家和地区的GMP法规的生产基地,并拥有覆盖全球的CMO合作伙伴,这意味着Ryzneuta?能够充分降低在全球生产供应成本,并充分提高供货效率,直送当地市场,充分发挥Ryzneuta?作为唯一一个与短效和长效升白药均进行了头对头比较的第三代长效升白药优势与潜力。在一些具有临床意义的指标上,Ryzneuta?临床疗效优于临床上原研短效升白药(非格司亭)和长效升白药(培非格司亭 Neulasta)
业内人士指出,作为第三代/非PEG修饰,Ryzneuta?兼具长效和强效的G-CSF产品,有望逐渐替代传统的前两代产品,满足市场对于“长效”、“高效低敏”等痛点需求。从国内外生物类似药的销售情况看,其上市后有望快速放量。
还有王炸?!

不止于此,亿帆医药正冲刺First-in-Class
Ryzneuta?在美国上市仅是亿帆医药创新药国际化的起点,是迈上新台阶的关键一步,借助这一Best-in-class创新药实现阶段性成果后,亿帆医药旗下亿一生物已经储备了First-in-Class的研发管线,冲刺上市全球首创新药。
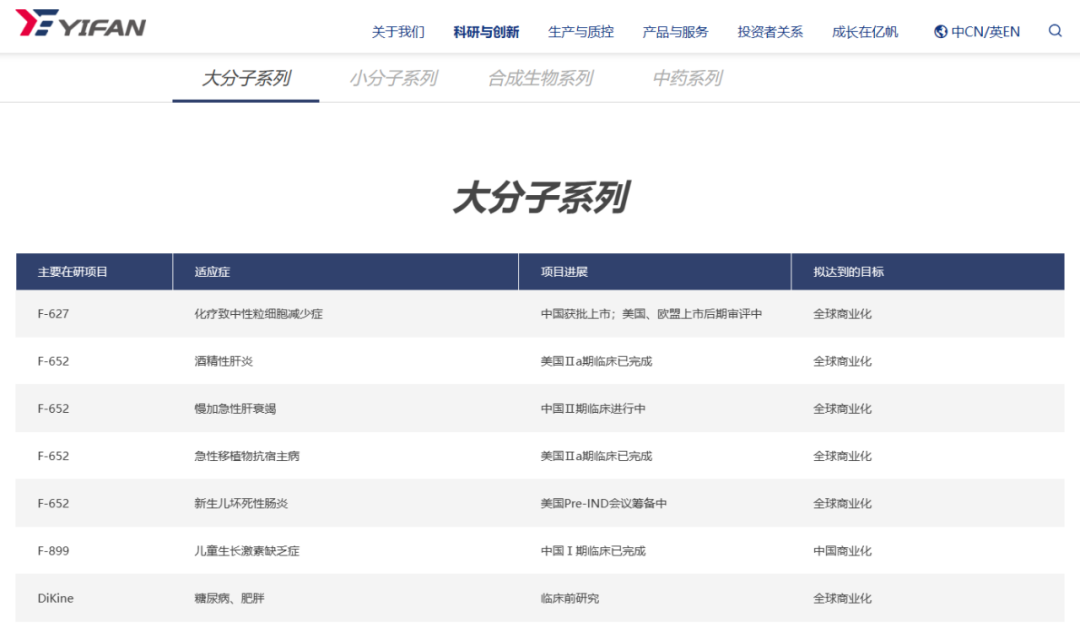
亿一生物在研管线
据了解,亿一生物F-652项目为全球首例 IL-22 重组蛋白类在研药物,并在中美申请了结构专利,是具有知识产权的全球首创药,潜在市场空间超50亿美元。目前正在开展临床试验的适应症包括急性移植物抗宿主病、酒精性肝炎、肝衰竭及胰腺炎,正在开展临床前研究的适应症包括坏死性小肠结肠炎及器官移植。
2019年10月22日,F-652被FDA授予治疗急性移植物抗宿主病的孤儿药资格。目前,F-652在美国已经完成了针对治疗急性移植物抗宿主病和急性酒精性肝炎的IIa期临床试验。
在此之外,亿一生物拥有全球范围60多项授权专利的技术平台,并且拥有具有在跨国药企和监管机构工作经验,全面覆盖新药研发所有关键环节的管理团队,并与纪念斯隆凯特琳癌症中心(MSKCC)、梅奥诊所(Mayo Clinic)、MD安德森癌症中心(MD Anderson)、美国国家卫生研究院NIH 、杜兰大学(Tulane Uni.)等国际顶级医疗机构合作开展临床前和临床开发项目,这意味着在两个Best-in-Class和First-in-class核心创新药研发项目之后,亿一生物还有更多创新药管线项目接续。
随着生物医药投融资冲高回落及创新药接连在美国上市遭遇“滑铁卢”,多家药企纷纷裁撤海外团队,整个中国医药界对于创新药出海国际化从过分期待变为有些过分悲观。
Ryzneuta?成功在美国上市,不仅为中国本土药企出海提供了一个绝佳的范本,更是中国生物创新药的里程碑事件,标志着公司自主研发创新的生物药正式走出国门,进入全球最大的药品消费市场,给市场上对于创新药出海上市颇有些悲观的当下,打了一针“强心剂”。