2024年第66届美国血液学会(ASH)年会将于12月7日至10日在美国圣地亚哥盛大召开。作为全球血液学领域规模最大、涵盖最全面、最受瞩目的国际学术盛会之一,ASH年会将邀请全球100多个国家的血液学专家和相关医疗保健专业人士共聚一堂,公布最顶尖的血液学领域研究摘要,分享和探讨全球前沿的研究进展和突破性临床研究成果及宝贵的临床实践经验。
ASH 官网
日前,ASH大会官网公布了入选摘要,引人瞩目的是中国学者主导的研究入选口头报告(Oral)和海报(Poster)数量创历史新高!这些研究成果不仅是血液学领域探索的最前沿标志,更彰显了中国在血液学研究版图上的坚实步伐与卓越贡献。
舒泰神将在本次会议上以海报形式发表STSP-0601注射液在伴有抑制物的血友病按需治疗方面的进展:
摘要号:1213
英文标题:A Specific Coagulation Factor X Activator for on-Demand Treatment in Hemophilia with Inhibitors
中文标题:特异性凝血因子X激活剂用于伴有抑制物血友病的按需治疗
时间:2024年12月7日星期六,下午5:30至7:30
报告人:刘葳

???
截图来源:ASH 官网
???
注射用STSP-0601的活性成
分是从圆斑蝰蛇毒液中纯化而成的凝血因子X激活酶,中文通用名称为“注射用波米泰酶α”,是一种首创的旁路制剂,其作用机制是通过特异性激活凝血因子X(FX),使其转化为FXa,促进凝血过程,从而达到止血效果。目前被开发用于治疗伴抑制物的血友病A和血友病B患者。
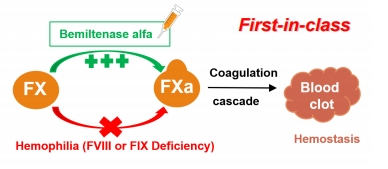
注射用波米泰酶α作用机制
这项Ib/II期临床研究的目的在于评估注射用波米泰酶α在成人伴抑制物血友病A及血友病B患者中的安全性和有效性,以及药代动力学(PK)和药效学(PD)特征。
Ib/II期临床研究分为两个阶段:
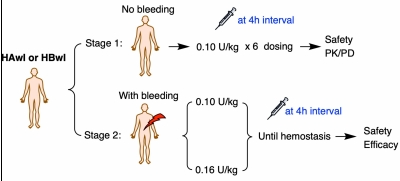
Ib/II期临床研究设计
研究入选年龄在18-65岁的成人男性伴抑制物血友病患者。研究分两个阶段进行。第一阶段中,血友病患者接受注射用波米泰酶α 0.10U/kg剂量的多次给药(每4小时一次),以评估其在血友病患者中安全性、药代动力学和药效学特征;第二阶段中,血友病患者发生出血事件后,分别接受注射用波米泰酶α 0.10U/kg或0.16U/kg剂量的按需治疗(每4小时一次),直至止血,以评估其在血友病患者出血按需治疗中的安全性和有效性。
研究共纳入63例血友病患者:其中包括59例A型和4例B型血友病患者,研究期间共收集了334例次出血事件,结果如下:
?安全性:所有与药物相关的不良事件(AEs)均为轻度或中度。未观察到与药物相关的严重不良事件(SAEs)、血栓栓塞事件或抗药物抗体(ADAs)。
?疗效:
?有效止血率达到90%以上:0.16 U/kg组为96.48%,0.10 U/kg组为94.07%。
?大多数出血事件在1-2次给药后即可止血:0.16 U/kg组为1.7±0.9次,0.10 U/kg组为2.1±1.1次。
?药代动力学和药效学:注射用波米泰酶α的血药浓度随着给药次数的增加而增加,并在给药2-3次后接近稳态。同时显著改善了活化部分凝血活酶时间(APTT)和凝血酶生成(TG)的峰值。
图:注射用波米泰酶α
治疗伴抑制物血友病的疗效结果
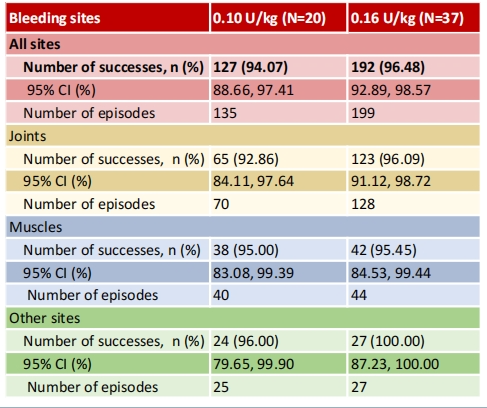
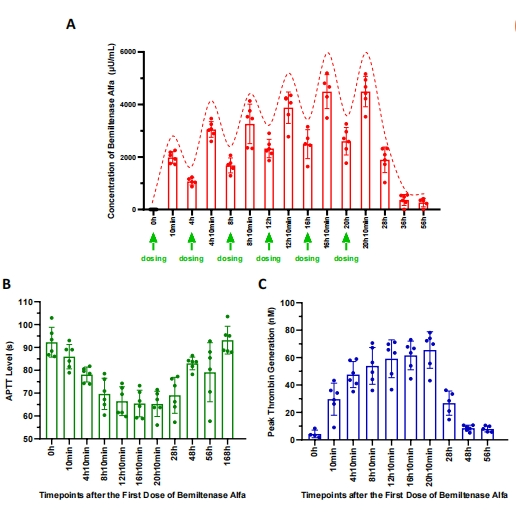
图.注射用波米泰酶α 0.10 U/kg多次给药后的PK和PD参数(第一阶段)。(A)血药浓度;(B)活化部分凝血活酶时间(APTT);(C)凝血生成峰值高度(Peak-TG)。
本研究首次证明了注射用波米泰酶α(FX激活剂)在血友病患者中具有显著的止血效果以及良好的安全性,有望为血友病(尤其是伴抑制物血友病)患者出血按需治疗提供一种新的治疗选择。
注射用STSP-0601是国家1类治疗用生物制品,其研发进展如下:
2019年07月31日,国家药品监督管理局批准注射用STSP-0601开展临床试验,适应症为“伴抑制物的血友病A或B患者出血按需治疗”;
2021年08月完成伴抑制物患者的I期临床试验(登记号:CTR20191930),安全性和耐受性良好;
2021年09月,启动了注射用STSP-0601Ib/II期临床试验(登记号:CTR20211762);2022年09月被纳入突破性治疗品种名单;
2023年11月,取得关于伴抑制物的血友病A或B患者出血按需治疗的Ib/Ⅱ期临床试验临床研究总结报告。
2022年09月,国家药品监督管理局批准注射用STSP-0601新增适应症开展临床试验,新增适应症为“不伴抑制物的血友病A或B患者出血按需治疗”;
2023年01月,完成II期临床试验的首例受试者给药;
2023年12月,取得关于不伴抑制物的血友病A或B患者出血按需治疗的II期临床总结报告;
2024年7月,注射用STSP-0601获得美国FDA孤儿药资格认定;
2024年9月,注射用 STSP-0601的活性成分凝血因子X激活酶取得INN(国际非专利名称)为“bemiltenase alfa”,药典委公示的中文通用名称为“注射用波米泰酶α”;
2024年11月注射用STSP-0601注射液受邀于第66届美国血液学会(ASH)进行海报展示。
关于舒泰神:
公司以自主知识产权创新药物,特别是生物药物的研发、生产和营销为主要业务,在中国证监会上市公司行业分类中归属于“C27医药制造业”类别。作为创新型生物制药企业,公司的产业链条完整,是拥有较为完善的研发、生产、质量管理、营销以及配套体系的高新技术企业。
公司致力于研发、生产和销售临床需求未被满足疾病的治疗性药物,主要包括蛋白类药物(含治疗性单克隆抗体药物)、化学药物等类别,治疗领域聚焦在感染性疾病、自身免疫系统疾病及神经系统疾病治疗药物等领域。