来源 :经观商业2021-11-10
年报数据展示

主要会计数据和财务指标
年度综评:2021年华海药业的营业收入为64.85亿元,同比上涨20.36%;归属于上市公司股东的净利润为65.13亿元,同比上涨16.10%。
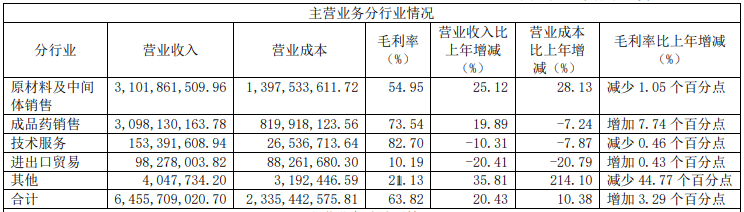
主营业务分行业情况
主营业务分行业情况方面,原材料及中间体销售的营业收入为31.02亿元,同比上涨25.12%,毛利率为54.95%,同比下降1.05%;成品药销售的营业收入为30.98亿元,同比上涨19.89%,毛利率为73.54%,同比上涨7.74%;技术服务的营业收入为1.53亿元,同比下降10.31%,毛利率为82.70%,同比下降0.46%;进出口贸易的营业收入为0.98亿元,同比下降20.41%,毛利率为10.19%,同比上涨0.43%。
年报中提示的公司日常经营中可能面临的风险因素
1、质量管控风险
2、安全环保风险
3、汇率变动风险
4、药品招投标风险
5、主要原料药产品价格波动风险
6、新产品开发风险
7、全球疫情持续蔓延及国际形势复杂多变的风险
媒体声音
证券时报:
《缬沙坦风波告一段落华海药业收到FDA警告信关闭通知》
11月8日晚间,华海药业披露收到了FDA(美国食品药品管理局)关于警告信关闭的通知函。根据通知函告知内容, FDA已完成公司针对警告信递交的整改措施的审评。基于审评结果,FDA认为公司已解决了警告信中提及的相关问题。警告信主要涉及的范围为华海药业川南原料药生产基地,涉及原料药29个产品。受2018年9月美国进口禁令的影响,到目前为止公司临海川南生产基地生产的原料药产品以及使用川南生产基地生产的原料药制成的制剂产品均没有出口到美国。
资料显示,2018年,国家药监局在对华海药业的检查中,发现其缬沙坦原料药中含有微量杂质。事发后,美国FDA人员亲自到华海药业的川南基地进行质量检查。同年,美国FDA对华海药业发出进口禁令,即其川南基地生产的所有原料药和制剂禁止出口到美国,随后欧盟也出台类似政策,并引发集体诉讼。
今年10月份,华海药业披露6月28日至7月2日接受了FDA有因检查,最终检查以零缺陷(NAI)通过。
华海药业系国内首家制剂通过美国FDA认证、实现规模化出口并在美国挑战原研专利的制药企业,占据大宗仿制药市场主要份额。截止2020年底,公司自主拥有美国ANDA文号66个,其中10多个产品在美国市场占有率名列前茅。去年,华海药业实现净利润约9亿元,同比增长约六成。不过,今年前三季度公司实现净利润近6亿元,同比下降近三成,其中第三季度净利润同比下降约7成。
投资者网:
《华海药业通过美国FDA检查海外仲裁未落地如何度过业绩阵痛期?》
2021年10月,华海药业发布两则公告,其临海的汛桥、川南等生产基地通过美国FDA(食品药品监督管理局)的CGMP(动态药品生产管理规范)检查,总共涉及产品69个。
通过美国FDA的检查,或意味着华海药业已度过“至暗时刻”。自2018年缬沙坦风波爆发后,华海药业的海外业务受影响较大,直到目前,其业绩仍处于阵痛期。其三季报显示,公司前三季度营业收入、归属于上市公司股东净利润分别同比下降5.6%、29.85%。对于业绩下滑的原因,华海药业表示受多重因素影响,如产品价格下跌、美元汇率下降、销售结构变化、原材料涨价等,原料药产品的利润大幅减少。这里面,产品价格和汇率都是短期波动,或多或少与海外业务有关。销售结构的变化,则显示出华海药业在阵痛期做出了调整。所谓变化,主要是公司从原料药向成品药拓展。2020年以来华海药业的成品药通过竞标国内集采迅速放量。2021年6月,华海药业公告其两个产品中标第五批全国集采,参考中选数量和价格,两个产品将为其带来0.24亿元收入。
因悬在头顶的仲裁之剑尚未落地,华海药业预提相应的负债。2021年半年报中,华海药业表示与山德士的案件或耗时两到三年,并预计缬沙坦事件造成的客户补偿支出约1.46亿元。不过,在通过美国FDA的检查后,华海药业的海外业务,尤其欧美板块或迎来业绩增长,从而一定程度对冲了海外诉讼的风险。
浙商证券研报认为,华海药业的制剂出口可能步入正轨,并对美国FDA禁令解除后的业绩做出预测。华海药业在美国的业务将经过市占率恢复、市占率维持、市占率上升等三个阶段,5年维度的收入空间在35亿至45亿元。