君实生物,是国内生物创新药头部企业,具备从药物发现到商业化的全产业链能力,通过源头创新寻求 first-in-class 或者 best-in-class 的药物。
2012 年创立;
2015 年新三板挂牌;
2016 年完成对上海众合医药的并购,共同开发单抗;
2018 年香港上市;
2020 年科创板上市申请通过。
PD-1 于中国、新冠药物于美国,皆为国产首家获批
自 2018 年 12 月,特瑞普利单抗,成为中国首个获批上市的的国产 PD-1 单抗以来,君实又斩获诸多国内与美国首个获批临床或上市。
2019 年 4 月与 2020 年 1 月,BTLA 单抗分别在美中获批临床,为全球首个进入临床的、继 PD-1 之后的潜在重磅新免疫检测点抑制。
2021 年 2 月,君实与礼来合作的埃特司韦单抗,是首个获美国FDA紧急使用授权(EUA)的中国原研的新冠中和抗体。
2021 年 12 月,VV116,成为乌兹别克斯坦首个批准紧急使用授权的新冠小分子口服药;目前已完成国内 I 期临床,正处于全球多中心 II/III 期临床中,大概率年内完成并提交上市申请。
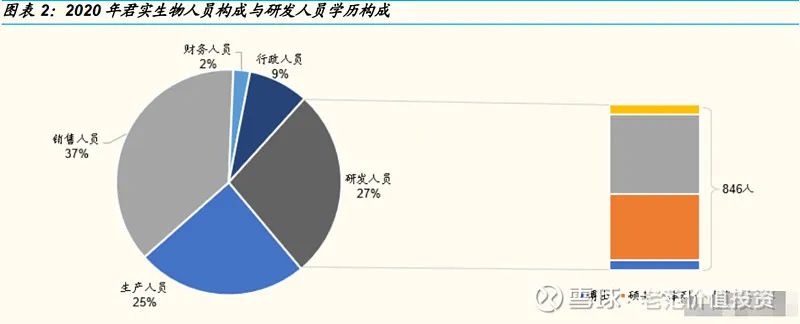
研发持续加码,内外开发双管齐下
从 2016 年开始,公司的研发投入一直保持高速增长的状态。2020年研发投入达到 17.78 亿元,同比增长 87.95%;2021年研发投入近 21 亿元。研发费用主要用于内部自研的投入增加以及通过与外部公司合作开发、权益引进的方式,拓宽创新管线。
公司在研的多条管线研发进度居世界前列。2015年特瑞普利单抗获得NMPA的IND批准,成为第一个由中国公司研发的获得 IND 批准的抗 PD-1 单抗。
2018 年,特瑞普利单抗在中国获批上市,成为国内首个获得国家药监局批准上市的国产抗 PD-1 单抗,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。
2020 年,特瑞普利单抗治疗复发性/转移性鼻咽癌 NDA 申请获 NMPA 受理;抗 BTLA 单抗(全球首创)获得美国 FDA 的 IND 批准;应对疫情,埃特司韦单抗研发进展迅速,成为首个在美国被批准使用的中国研发创新药物。
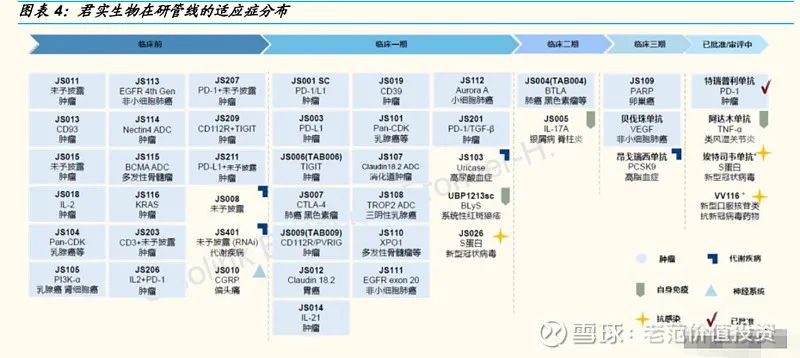
突破 Breakeven,在研管线丰富,商业化后劲可期
君实生物产品覆盖肿瘤免疫治疗、代谢类疾病、抗感染、自身免疫和神经系统 5 大热门治疗领域。其中,有 3 个处于商业化阶段(特瑞普利单抗、埃特司韦单抗和 VV116)、1 款产品处于上市申请阶段。
君实生物营收的快速增长得益于特瑞普利单抗、埃特司韦单抗的销售收入。在 2021 年上半年首次突破盈亏平衡,实现归母净利润 900 万元。根据最新业绩预告,2021 年总营收过 40 亿元。

引进补充自研产品管线,携手 Coherus 推进美国商业化进程
君实生物积极寻求国内外优秀的生物科技公司,通过获取权益、股权投资的方式拓展产品管线,加大在药物联合治疗领域的布局,构建起以特瑞普利单抗为中心,多层次用药的产品梯队。公司的合作范围涉及单抗、小分子药、ADC药物等。
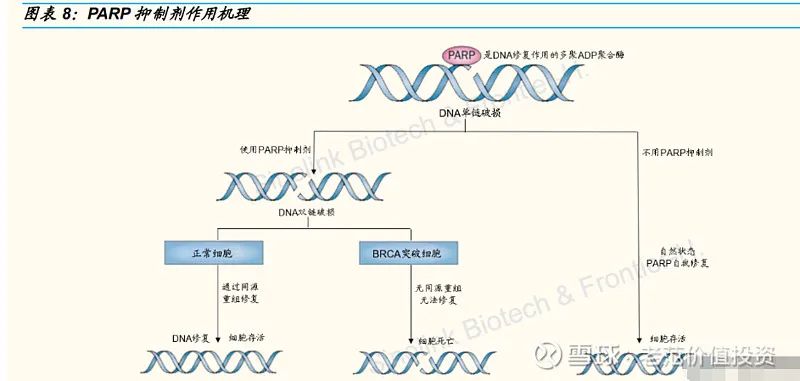
2020 年 8 月,君实与英派成立君派英实药业有限公司,英派向合资公司转让 IMP4297(JS109)相关所有权。IMP4297 是一种靶向聚-ADP 核糖聚合酶(PARP)的小分子抑制剂,利用出现 BRCA1/2 基因突变的肿瘤细胞具有同源重组修复缺陷的特点,特异性杀死细胞。IMP4297 正在进行具有 BRCA 突变的晚期卵巢癌患者的临床三期研究。
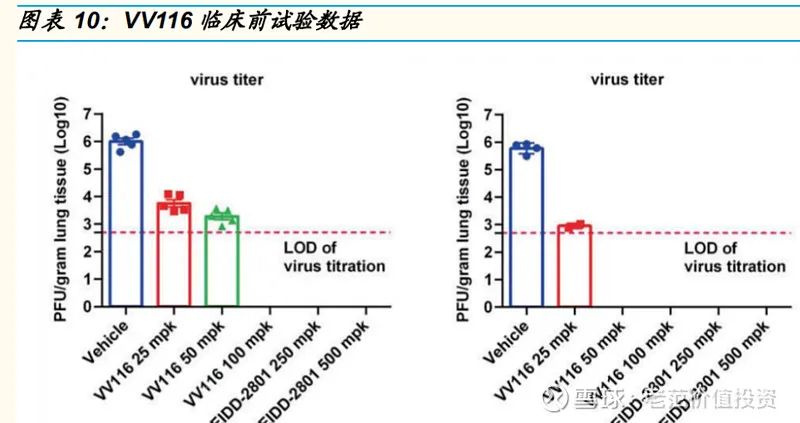
2021 年 10 月,君实与旺山旺水公司达成合作,共同承担口服新冠候选药物 VV116 的临床和商业化工作。VV116 是一个三异丁酸酯前药的氢溴酸盐形式,口服后可以迅速代谢为 VV116 核苷。临床前数据显示,VV116 出现显著的抗新冠病毒作用,在小鼠模型中,VV116 和 Molnupiravir 都显示出了将肺部病毒滴度降低至检测线以下的能力。2021年12月30日,VV166 在乌兹别克斯坦取得 EUA,成为继 Molnupiravir、Paxlovid 之后全球第三款获批的口服新冠药物。2022 年 1 月,君实宣布与旺山旺水公司共同开发 3CL 蛋白酶的口服新冠药,临床前研究表明可以降低病毒复制,显著改善肺部感染,且具有较好的安全性。
2021 年 2 月,君实与 Coherus 签署商业化合作协议,授予 Coherus 在美国和加拿大关于特瑞普利单抗的独家许可以及两个可选项目(JS006 和 JS018)的优先谈判权。此次交易Coherus将支付公司1.5亿美元的首付款以及不超过3.8亿美元的里程碑款项。
特瑞普利单抗 NSCLC 上市申请获受理,大适应症格局扭转在即
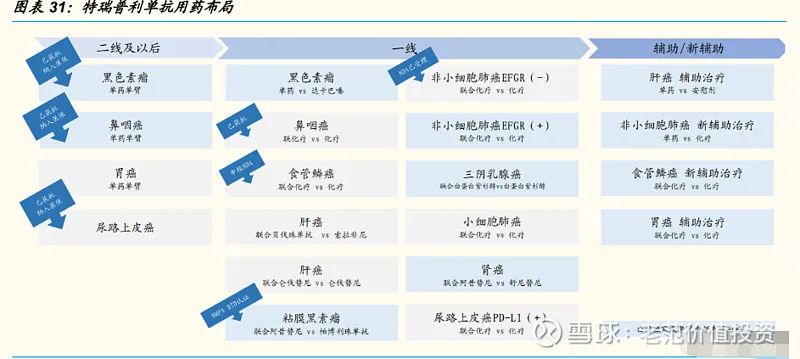
对标国内,君实产品拓益(通用名:特瑞普利单抗)是中国首个研发并上市的抗PD-1单抗,于 2018 年 12 月获批,进度领先于其他国产 PD-1 研究,具有一定的先发优势。公司拥有不少于 20 项关于特瑞普利单抗的临床试验,其中关于黑色素瘤二线治疗、鼻咽癌一线、三线治疗、尿路上皮癌二线治疗已经获得NMPA批准,非小细胞肺癌的一线治疗上市申请已经获 NMPA 受理。
中国 PD-1/PD-L1 市场增速超全球,目前处于发展的黄金阶段。
根据君实生物招股书,2020 年全球 PD-1/PD-L1 单抗市场规模为306亿美元,预计 2025 年这一数字可达 75 亿美元。尽管中国的 PD-1 研究晚于全球,但目前登记在册的关于 PD-1 的临床试验记录多达 60 条,有 12 款处于批准上市+上市申请阶段。随着越来越多的国产 PD-1 获批,中国的 PD-1 竞争格局愈发激烈。
自 2018 年 K 药和 O 药进入中国市场,加之国产 PD-1 获批,中国的 PD1/L1 单抗的销售规模增速迅猛,且参与厂商越来越多。仅考虑 PD-1 的销售收入,2020 年中国 6 家获批的 PD-1 药品销售额达 107.87 亿元,同比增长 350%。2021 年 8 月,康方生物的派安利普单抗以及誉衡生物的赛帕利单抗取得上市批准。至此,我国形成了“2 款进口+6 款国产”的 PD-1 销售格局。
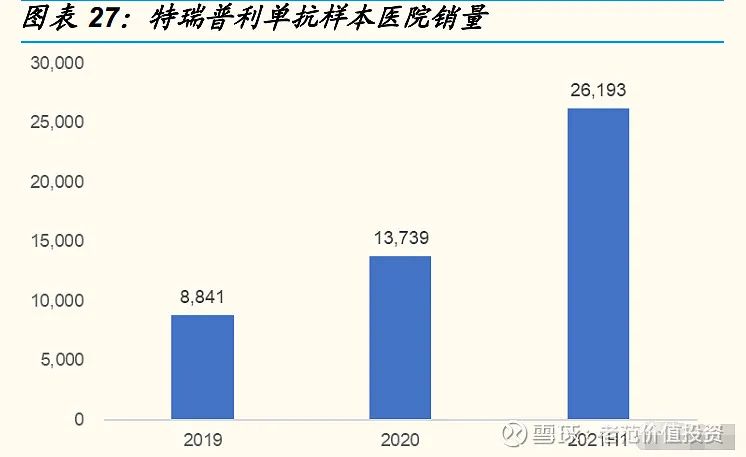
进入医保,以价换量。2021 年医保谈判,特瑞普利单抗用于鼻咽癌、尿路上皮癌的治疗谈判成功,特瑞普利单抗纳入医保的适应症数量增加至 3 种。从销量来看,2021 年上半年特瑞普利单抗的销量已经接近 2020 年全年销量的两倍。我们认为,医保降价、医保覆盖适应症增多对于产品销量的提升具有积极的促进作用,尤其是在黑色素瘤治疗上,目前国产 PD-1 产品中尚未有此适应症的获批。
适应症范围日益扩大,肺癌大适应症即将获批
对比进口与国产 PD-1/PD-L1 的获批适应症范围,可以看出国产 PD-1 产品获批适应症数量总体少于进口 PD-1/PD-L1 产品。海外 PD-1/L1 产品获批适应症种类较多,涉及到 22 种癌症类型,国产 PD-1 产品仅涉及 8 种癌症类型。国产 PD-1 单抗多选择从小适应症入手,例如霍奇金淋巴瘤、鼻咽癌、黑色素瘤;再往大适应症延伸,例如信达、恒瑞、百济神州已经获批非小细胞肺癌适应症。
特瑞普利单抗是国产 PD-1 单抗中唯一被批准用于治疗晚期黑色素瘤的药物。与 K 药相比,特瑞普利单抗具有一定竞争优势。从临床数据来看,在亚洲患者常见的肢端型黑色素瘤中,两种药物的反应率差距较小。但特瑞普利单抗在 PD-L1+患者中表现更好。
向前线治疗方案进军,鼻咽癌联合化疗一线治疗已获批,食管鳞癌一线治疗递交 NDA。与后线治疗相比,一线治疗往往具有更长的用药时间,有助于提高药品的销量。我们认为,随着公司二线布局的完善以及一线适应症上市申请稳步推进,预计特瑞普利单抗的适应症获批将进入爆发期。
特瑞普利单抗联合化疗用于一线治疗鼻咽癌的研究成果以封面形式发表在?《自然-医学》杂志,这是首个证明比起单纯化疗,联合治疗可以获得更好的 PFS(无进展生存期)和 OS(中位总生存)的国际三期临床试验。联合疗法的 ORR(客观缓解率)为 77.4%,单独化疗的 ORR 为 66.4%。
公司已向 FDA 滚动提交了用于治疗复发或转移性鼻咽癌的 BLA,目前已经受理,FDA 给予优先审评认定,拟定的处方药用户付费法案?(PDUFA)目标审评日期为 2022 年 4 月。未来公司将继续提交在食管鳞癌、肺癌、三阴性乳腺癌等大癌种的在美上市申请。通过增加获批适应症来加大产品的应用空间,进而提高市场份额。
特瑞普利单抗联合化疗用于一线晚期食管鳞癌临床数据显示,联合疗法组 OS 和安慰剂组中位 OS 分别为 17 个月和 11 个月;与安慰剂组相比,联合疗法组 PFS 显著改善(HR=0.58 [95% CI:0.46-0.74],P0.00001)。
中和抗体项目进展迅速,创造多个“第一”
应对新冠疫情,君实生物与中国科学院微生物研究所开展新冠中和抗体(埃特司韦单抗)项目,仅用 4 个月就完成抗体的临床前开发工作,是全球首个在健康受试者中开展的新冠病毒中和抗体临床试验,也是国内最早进入临床阶段的新冠病毒中和抗体。
2020 年 5 月,君实牵手礼来,授予礼来在大中华地区之外对埃特司韦单抗的独占许可。根据协议,礼来制药需要向公司支付 1000 万美元的首付款以及不超过 2.45 亿美元的里程碑款项,以及后续产品销售金额两位数百分比的销售分成。
除了与君实合作开发埃特司韦单抗之外,礼来在 2020 年 3 月与 AbCellera 合作,取得了巴尼韦单抗(LY-CoVer555)共同开发权。
2021 年 7 月,关于联合使用埃特司韦单抗和巴尼韦单抗的“鸡尾酒”疗法治理轻度至中度新冠患者的三期试验达到主要研究终点,临床数据发表在《新英格兰医学杂志》。这项随机、双盲、安慰剂对照的三期临床结果显示,联合疗法组出现住院或者死亡的概率较低,且病毒载体下降的速度更快。
2021 年 2 月,FDA 批准“鸡尾酒”疗法的紧急使用授权(EUA),用于轻度或中度新冠患者;2021 年 12 月,FDA 批准了联合疗法的 EUA 范围扩大至 0-12 岁高危儿科患者,是全球首个且唯一能在 12 岁以下人群中紧急使用的中和抗体疗法。目前,联合抗体疗法已在全球超 15 个国家和地区获得 EUA。
2021 年 8 月,FDA 决定重新给予君实/礼来联合疗法 EUA。当时,由变异株Delta引起的新冠病例占比高达96%,考虑到中和抗体对于Delta变异具有良好的中和抗体,FDA重新授予君实/礼来中和抗体EUA。

2021 年 9 月,美国政府向礼来购买了38.8万剂埃特司韦单抗,价值3.3亿美元;2021 年 11 月,美国政府向礼来再度采购 61.4 万剂联合疗法用药,价值12.9亿美元。根据协议,礼来需要在2021年12月31日前向美国政府提供至少40万剂联合疗法用药。此次采购,再次证明了美国政府对联合疗法在新冠治疗上的认可。