美迪西在ADC药物的临床前一体化研究方案制定中与客户深入交流,将每一个案例的特点与多年实战经验和技术积累相结合,谨慎地将优质实验方案与结果提交到客户手上。美迪西可以为客户提供ADC Payloads合成、ADC药物偶联、ADC药效学评价、ADC药代动力学评价和ADC安全性评价等服务。截至2022年末,美迪西已成功助力12个ADC药物获批临床,并有10多个ADC项目在研。
解决方案
截至目前,美迪西承接的IND申报类生物药大项目已经100多项,包括单抗、双抗、多抗、ADC、病毒疫苗和融合蛋白等。截至2022年末,美迪西已成功助力12个ADC药物获批临床,并有10多个ADC项目在研。
?Payload (50+):DX8951f, SN-38, DM1, DM4, Exatecan, Dxd, MMAE/MMAF, Tubulysin M, PBD dimer, Seco-Duocarmycin MA, PNU159682, Doxorubicin analog等
?Linker (200+):具有多种Cleavable和uncleavable、亲水性和疏水性以及新型Linker,如:Gly-Gly-Phe-Gly,VC-PAB, SMCC, N-SMP等
?Payload+Linker (30+): SN-38-PEG-PAB, DXD-GlyGlyPheGly, DXD-VCPABDM1-SMCC, DM1-SPP, DM4-SPDB, MC-VC-PAB-MMAE/MMAF, MC-Val-Ala-PBD, VC-PAB-Dolastatin 10等
?美迪西已完成靶点:Her2、Her3、Trop2、Claudin 18.2、CD33、Muc1、FR等;
?美迪西有着开发并验证针对不同靶点分析方法的丰富经验,能够有效根据需求分析靶点的表达水平、以及靶点可及性,为靶点的选择提供建设性意见。
ADC Payloads合成
美迪西的ADC Payloads分子库可以有效解决细胞毒素的选择难题,在ADC Payloads分子库中有美迪西药物发现团队积累了多种不同作用机制、不同种类的细胞毒素可供客户选择,同时可以定制合成客户所需要的一种或几种ADC细胞毒素,满足数量上的需求。通过自研和对外合作,美迪西可以提供所有已经上市ADC药物的6种毒素可以提供已经上市ADC中毒素的衍生物达20种以上可以合成自研类毒素。
?微管蛋白抑制剂
?DNA 损伤剂
?免疫调节
ADC偶联策略
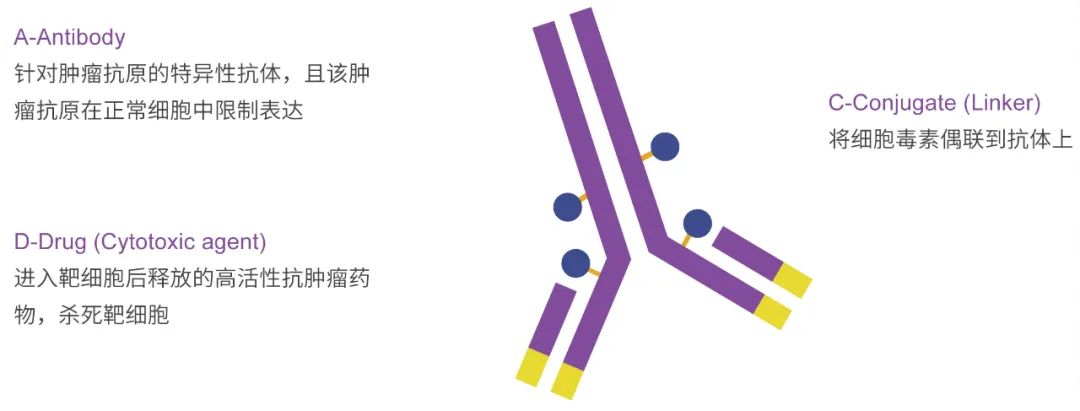
ADC 的三个主要组成部分是抗体(Antibody)、连接子(Linker)和有效载荷(Payload)。
?抗体负责靶向结合,可以是单克隆抗体、Fab抗体、双特异性抗体或纳米抗体。
?连接子连接抗体和Payload。分为可切割和不可切割两种类型。连接子是ADC稳定性的关键,负责何时释放有效载荷。
?Payload通常是一种具有明确作用机制的高活性毒素分子。对肿瘤细胞具有一定的杀伤作用。
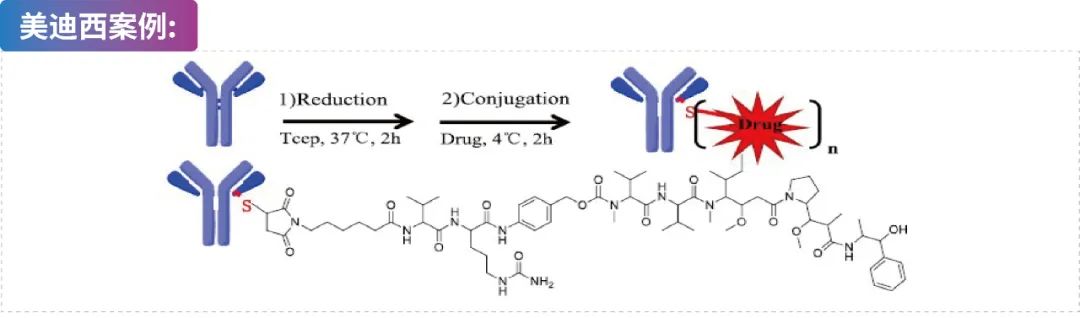
基于半胱氨酸的ADC偶联
?提供5 mg、50 mg、500 mg等抗体量级的偶联服务,实验周期:2-4周。
?QC方法包括SEC、HIC、LC-MS/MS等。
?DAR值≈4。
?提供其它偶联方法的开发服务。
ADC药物体外研究
美迪西拥有300种以上的肿瘤细胞系,多种可供选择的ADC靶蛋白表达阳性和阴性的肿瘤细胞。并且提供靶点过表达细胞系构建服务,可以为客户提供多种已知靶点的旁观者效应分析服务。此外,美迪西生物团队拥有丰富的细胞标记经验及基于FACS的细胞活力分析能力。
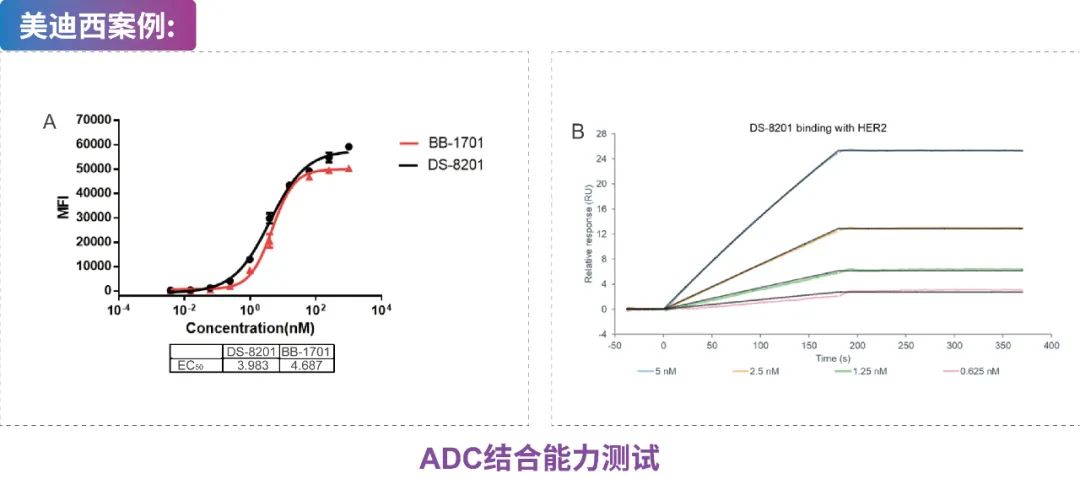
A:将HER2 ADC (BB-1701和DS-8201)与N87细胞共孵育,然后进行FACS分析。
B:将HER2蛋白固定在M5芯片上,将DS-8201梯度稀释后注入芯片,通过Biacore 8K分析HER2和DS-8201的结合亲和力。
?流式细胞术分析ADC与抗原表达细胞的结合能力(图A:HER-2 ADC DS-8201、BB-1701与BT-474细胞结合能力测试)
?SPR分析ADC与抗原蛋白的结合能力(图B:DS-8201与HER2蛋白结合测试)。
?提供ELISA, HTRF等其它方法的结合能力测试。
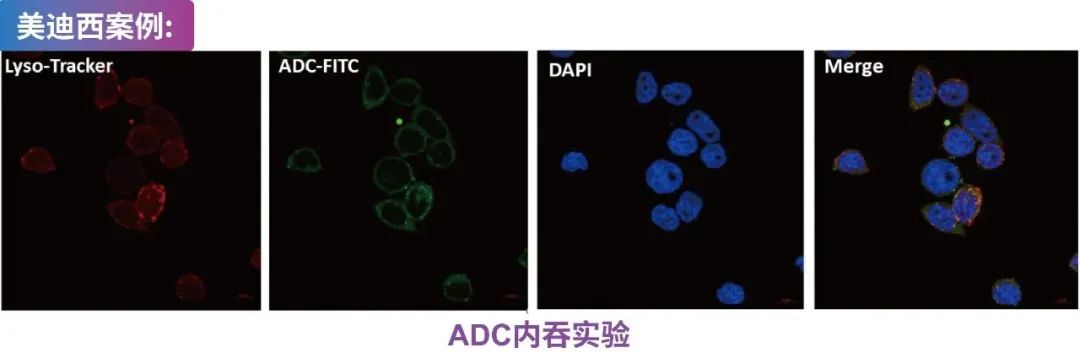
OVCAR-3 细胞与 FITC 标记的 ADC 孵育 24 小时,再与 Lyso-Tracker 和 DAPI 一起孵育,然后通过共聚焦显微镜进行分析。
?美迪西可提供ADC荧光标记服务(如ADC-FITC,ADC-Cy5等)
?利用共聚焦显微镜分析抗体内吞(与溶酶体标记lyso-tracker共染色分析内吞部位)。
?利用荧光Western或流式分析内吞效率
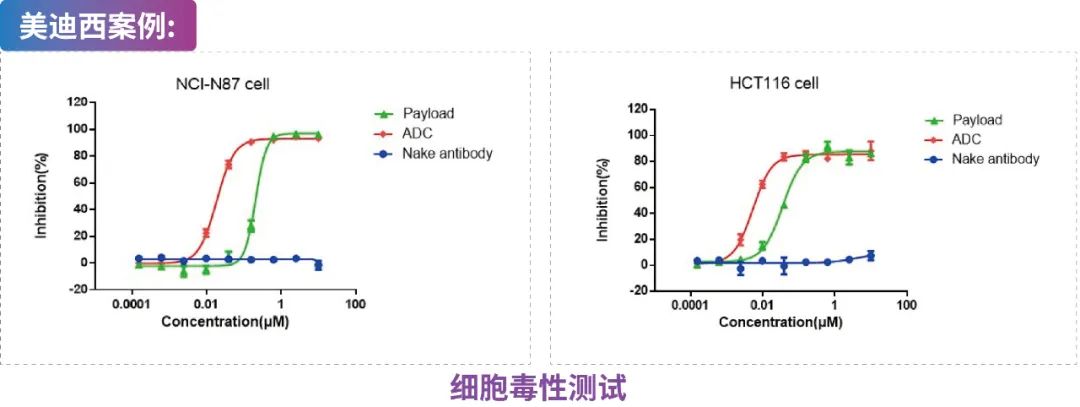
ADC,裸抗及Payload与靶细胞共孵育,通过CCK-8、CTG、MTT等方法测试各个待测物对肿瘤细胞的毒性。
(图:ADC,裸抗及Payload对NCI-N87及HCT116细胞的生长抑制曲线)
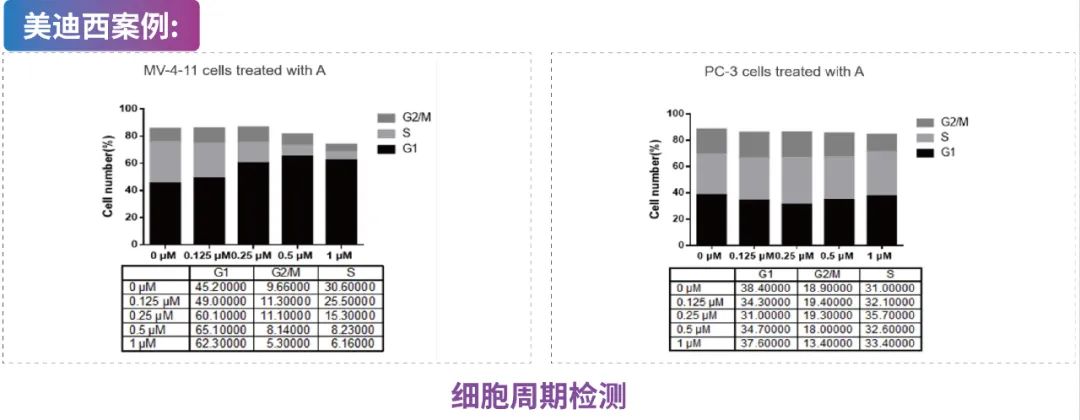
MV-4-11细胞(人髓性单核细胞白血病细胞)和PC-3细胞(人前列腺癌细胞)用Compound A处理并用PI染色,进行基于FACS的细胞周期分析。数据显示Compound A显著阻断MV-4-11细胞周期,对PC-3细胞没有太大影响。说明Compound A具有适应症特异性。
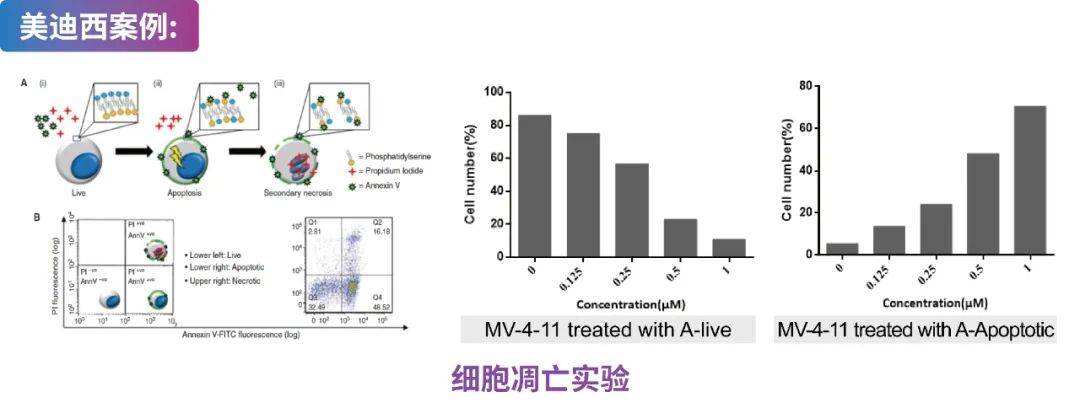
MV-4-11细胞用Compound A处理并使用 PI/Annexin V染色,然后进行 FACS 分析。数据显示Compound A促进MV-4-11细胞凋亡。
ADC药理学研究
?靶抗原结合活性
?靶抗原相关药理作用(如:ADCC,CDC)
?小分子化合物及活性代谢产物的作用机制(关注ADC与裸抗、游离小分子化合物或药理活性代谢物之间的药理作用差异,以及抗原表达水平对药理作用的影响)
?内化、装解以及裂解后主要的游离小分子化合物的效应
ADC药效学评价
ADC的动物体内药效试验是ADC研究中一项重要的药理参数,它直接反映了ADC的功效并影响临床试验设计。美迪西致力于为客户提供成熟的评估ADC体内药效的肿瘤模型,在AAALAC认证的环境下完成模型动物的建模和饲养,并以GLP-like的高标准完成相关药效学评价试验。
?目前美迪西已建立六大类近300种的肿瘤评价模型,能覆盖大部分常规肿瘤疾病。
?ADC药物评价模型:转基因模型、异种肿瘤移植模型、同种肿瘤移植模型、PDX模型、人源化肿瘤移植模型、原位移植模型
?多种实验动物:啮齿类(小鼠/大鼠、兔子);非啮齿类(比格犬、小型猪、非人灵长类动物)。
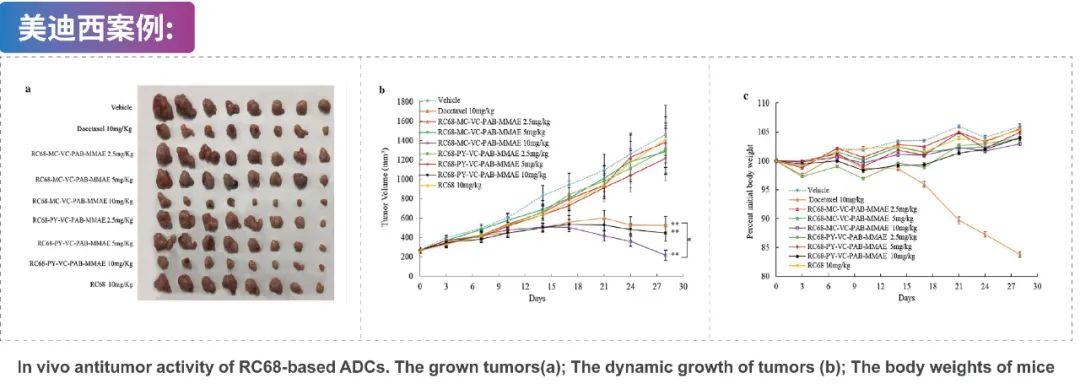
通过MC-VC-PAB或PY-VC-PAB连接子使纯化的人源化抗EGFR单克隆抗体(RC68)与MMAE偶联生成RC68-MC-VC-PAB-MMAE和RC68-PY-VC-PAB-MMAE。RC68-MC-VC-PAB-MMAE和RC68-PY-VC-PAB-MMAE的体内抗肿瘤活性检测通过美迪西进行。BALB/c裸鼠皮下移植H125细胞,当肿瘤长到 100-300 mm3 时,将小鼠随机分组并每周用指定药物进行静脉给药。通过测量肿瘤体积和小鼠体重从而衡量每种药物对的影响。10 mg RC68-MC-VC-PAB-MMAE或RC68-PY-VC-PAB-MMAE 给药处理后显著抑制小鼠H125肿瘤的生长,且不影响小鼠体重。
ADC药代动力学评价
由于ADC药物组成成分复杂,其PK特性必须借助多个分析物的评估,因此增加了分析的难度。美迪西在ADC药物的体内分析中为各种ADC组分分析物提供了多种高质量的测试方法,通过分析动物体内采集的血浆/血清样本,为客户提供可靠优质的PK数据。

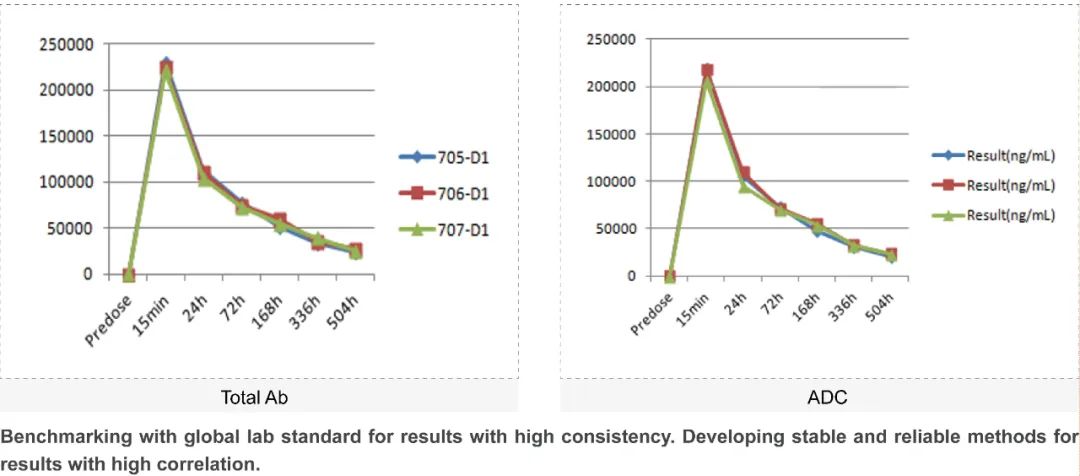
ADC免疫原性测定
免疫原性测试是生物药的重要测试指标,需在研究的各个阶段全程把控。生物药的免疫原性可能会导致ADC在体内的快速清除,影响其PK特性的测定。不仅如此,免疫原性还可能对ADC的药效学和毒理学研究产生影响。
ADC安全性评价
美迪西毒理研究部遵循ICH指导原则S6和S9,结合每一个项目的具体情况定制个性化的安全性评价方案,提供符合NMPA、FDA、OECD、TGA等国际GLP标准的安全性评价服务,包括:
?单次和重复给药毒性试验(伴随毒代动力学研究)
?安全药理(包括组织交叉反应)
?免疫原性检测

关于美迪西
美迪西(股票代码:688202.SH)成立于2004年,总部位于上海,致力于为全球制药企业、研究机构及科研工作者提供全方位的临床前新药研究服务。美迪西的一站式综合服务以强有力的项目管理和更高效、高性价比的研发服务助力客户加速新药研发进程,服务涵盖医药临床前新药研究的全过程,包括药物发现、药学研究及临床前研究。至2022末,美迪西已为全球超1840家客户提供药物研发服务,参与研发完成的新药及仿制药项目已有330件IND获批临床,与国内外优质客户共同成长。美迪西将继续立足全球视野,聚力中国创新,为人类健康贡献力量!