来源 :Insight数据库2023-03-01
2 月 28 日,据 Insight 数据库显示,荣昌生物泰它西普启动 III 期临床,用于治疗原发性 IgA 肾病患者。

这是一项随机、双盲 III 期临床研究,旨在评估泰它西普在具有进展为终末期肾病(ESRD)风险的原发性 IgA 肾病患者治疗中的有效性和安全性(登记号:CTR20230482)。
CTR20230482 试验信息
IgA 肾病(IgA Nephropathy,IgAN)是最常见的原发性肾小球肾炎之一,在我国约占原发性肾小球疾病的 25%- 50%,其中 25%-30%在 20 年内会发展成终末期肾病(ESRD)。
根据弗若斯特沙利文的资料,全球 IgA 肾病患者总数预计将于 2030 年达到 1016 万人,其中我国 237 万人。目前,IgA 肾病的标准疗法包括肾素-血管紧张素-醛固酮系统阻断剂及免疫抑制剂,患者亟需用于治疗该疾病的特定疗法。
此前,泰它西普治疗 IgA 肾病的 II 期临床研究(登记号:NCT04291781)数据在 2021 美国肾脏病学会年会上亮相。
试验结果显示,用药 24 周后,泰它西普 240 mg 组受试者尿蛋白水平与基线相比显著降低,24 小时尿蛋白平均水平较基线下降了 49%,相对于安慰剂组有统计学意义(p 0.05)。研究表明,泰它西普减少了高风险 IgA 肾病患者的蛋白尿,能够有效降低 IgA 肾病的进展风险,且安全性良好。
基于此,FDA 已在 2022 年 11 月批准其在美国开展该适应症的Ⅲ期临床试验。
NCT04291781 试验结果

泰它西普是由荣昌生物 CEO、首席科学官房健民教授发明设计的一个抗体融合蛋白药物分子,通过同时抑制 BLyS 和 APRIL 两个细胞因子的过度表达,「双管齐下」阻止 B 细胞的异常分化和成熟,从而治疗 B 细胞介导的系统性红斑狼疮等一系列自身免疫性疾病。
2021 年 3 月,泰它西普首个适应症获得国家药监局在国内的附条件上市批准,用于治疗系统性红斑狼疮(SLE),该药由此成为治疗 SLE 的全球首款双靶标生物新药。
2022 年 9 月,荣昌生物宣布其已完成泰它西普治疗系统性红斑狼疮(SLE)患者的国内Ⅲ期确证性研究,并获得初步数据结果。
NCT05306574 临床试验结果

在Ⅲ期国内确证性临床研究完成时,泰它西普治疗系统性红斑狼疮患者的全球多中心Ⅲ期临床试验正在顺利推进,并于 2022 年上半年在美国完成首例受试者入组给药。该项研究是在中至重度活动性系统性红斑狼疮患者中评价泰它西普有效性和安全性的多中心、随机、双盲、安慰剂对照的两阶段试验,预计位于北美、中美洲/南美洲、欧洲、亚洲和全球其他地区的百余家研究中心将参与本研究。
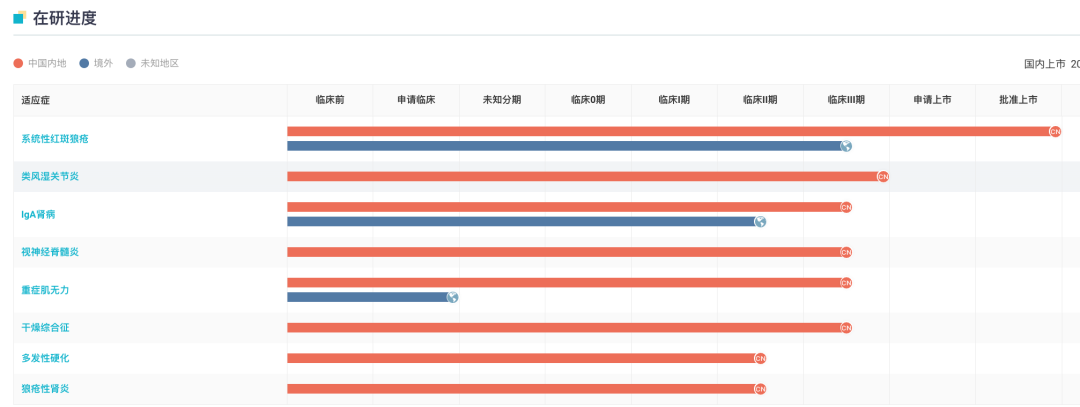
除系统性红斑狼疮以及 IgA 肾病外,泰它西普治疗类风湿性关节炎、重症肌无力、原发性干燥综合征、视神经脊髓炎谱系疾病、多发性硬化等适应症的Ⅱ/Ⅲ期临床研究也在推进中。
泰它西普全球在研进度甘特图