来源 :安必平2026-02-04
2025年11月,安必平研究三院院长朱俊轩博士代表公司出席第71回日本病理学会秋季特别总会,并发表专题报告,重点分享了全球唯一获批的Claudin18.2伴随诊断用抗体克隆(43-14A),及该抗体在不同的染色平台(Ventana Benchmark Ultra及Leica BOND III)上的检测一致性相关研究成果[1]。本次研究由安斯泰来公司赞助发表,报告引发日本及亚洲多国家和地区病理专家的高度关注,现场研讨氛围热烈,专家们围绕Claudin18.2检测的相关性、泛用性及可及性展开深入探讨,展现出浓厚兴趣。

ihc
Claudin18.2(43-14A)
43-14A克隆号是由安斯泰来公司开发并拥有唯一知识产权的针对Claudin18(包含Claundin18.1和Claudin18.2)小鼠来源的单克隆抗体,也是安斯泰来公司针对Claudin18.2靶点的单克隆抗体治疗药物Vyloy (zolbetuximab)的唯一指定伴随诊断用抗体试剂。值得一提的是,安必平拥有安斯泰来公司Claudin18.2(43-14A)在开发诊断试剂的官方授权,并同时拥有该克隆的I类备案证,相关的伴随诊断三类注册也同步在计划中。
本次Claudin18.2研究成果展示
本次研究纳入了80例胃癌手术样本,在Roche Benchmark Ultra平台上,使用完全相同的二抗及染色程序,分别使用43-14A(Roche)、43-14A(安必平)和LBP1(安必平)一抗进行了头对头比较。结果显示,三者无论在任何阳性判断值(Cut off值)下,均显示出极高的一致性(≥99%)。同时,其中的58例也通过Leica BOND III平台使用43-14A(安必平)进行了染色和比较。结果显示,43-14A(安必平)应用于Leica BOND III平台的方案,较Roche Benchmark Ultra平台敏感性略高,但两者在任何阳性判断值(Cut off值)下,依然显示出极高的一致性(91%~99%)。
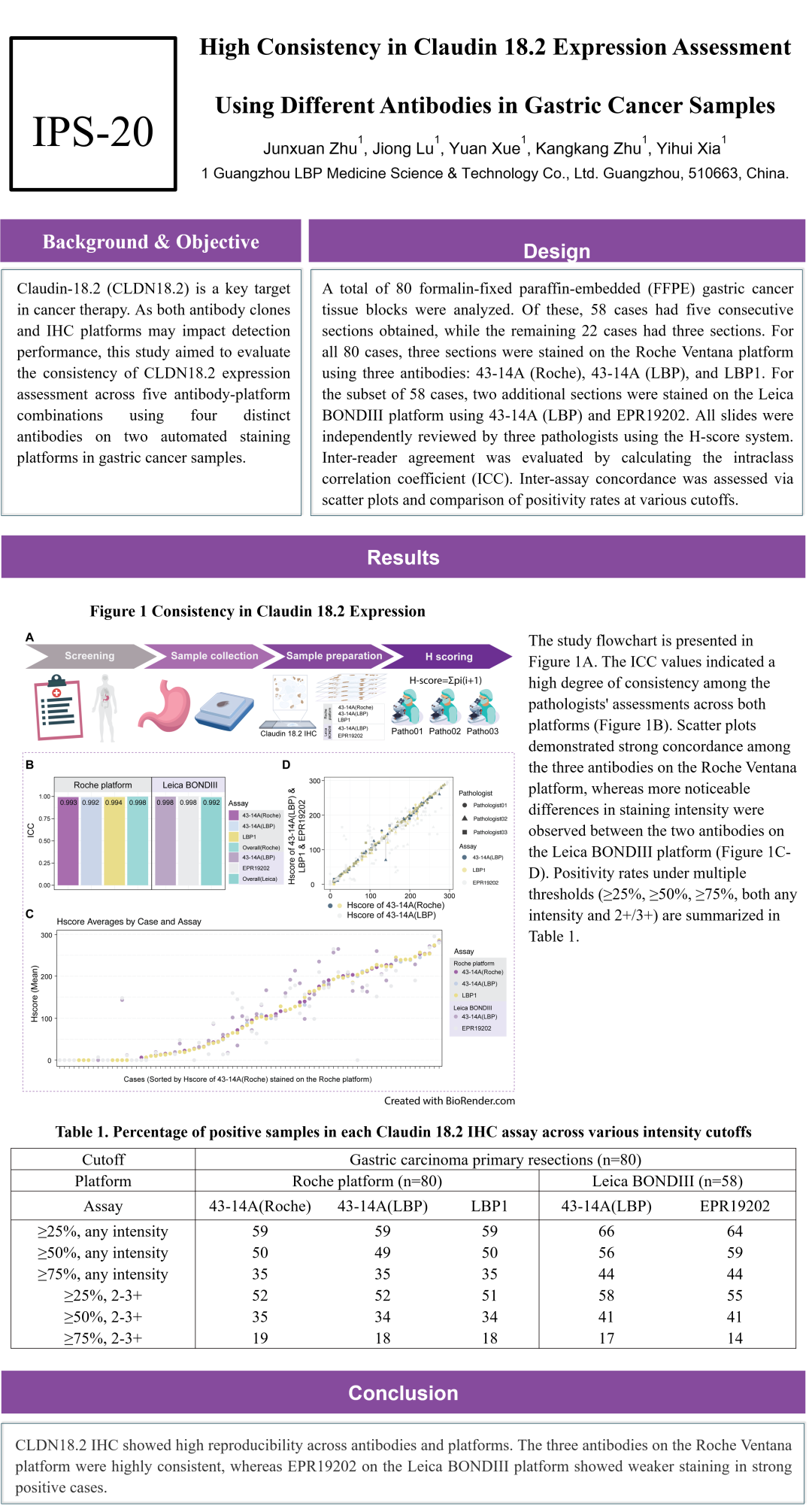
向下滑动查看所有内容
关于Claudin18.2
胃癌被称为“中国式癌症”,中国胃癌新发病例和死亡病例占全球近半,晚期患者5年生存率不足10%,呈现发病率高、死亡率高、进展期比例高,早期诊断率低、生存质量低、治疗选择低的“三高三低”特征。我国胃癌患者现有治疗手段仍然有限,亟待新的治疗药物与方法。尽管针对HER2的靶向治疗已在胃癌领域取得一定进展,HER2阳性晚期患者患者可从抗HER2治疗中获益,但胃癌患者中HER2阳性率仅10%左右,仍有超过90%的患者无法获得从中获益。Claudin18.2被认为是胃癌领域继HER2之后的第二个重要靶点,在胃癌中阳性率约为38%,意味着又为超过三分之一的胃癌患者提供了新的治疗方案选择。2025年CSCO胃癌诊疗指南更新后,Claudin18.2的检测的推荐等级由II级(2A类)提升为I级(1B类),伴随首个靶向Claudin18.2的药物佐妥昔单抗在国内批准上市,胃癌诊疗在继HER2之后进入了第二个重要进展阶段,为晚期胃癌患者的一线治疗带来新选择。
免疫组化(IHC)是检测Claudin18.2的主要方法,推荐使用经过充分临床验证的检测试剂(克隆号43-14A抗体)。Claudin18.2的检测阳性定义为≥75%的活性肿瘤细胞显示出中度(2+)至强(3+)的膜染色,对于染色的效果和质控都提出了更高的要求。
在关键三期临床试验SPOTLIGHT和GLOW中,均使用了43-14A克隆进行研究和检测,用于明确G/GEJ腺癌患者Claudin18的表达状况。43-14A克隆识别Claudin18的C端,多项研究均显示,泛Claudin18检测抗体(43-14A)相比较于其他克隆具有更高的灵敏度和特异性,且在多个平台表现一致性高1-2,适宜用于院内Claudin18.2的检测。
安必平产品介绍
安必平两个不同克隆(43-14A克隆、及LBP1克隆)均展示出与原研试剂高度的一致性,阴性一致率和阳性一致率均达到100%。染色清晰,无非特异背景着色,可适配多种主流平台,确保检测的准确性和一致性,进一步助力胃癌精准诊疗。